快速降温下磁场强化SBR处理低温废水COD去除研究
摘要:该研究通过磁场强化弥补生物反应器低温运行的不足, 考察磁场作用下活性污泥微生物在快速降温、复温冲击条件下磷脂脂肪酸 (PLFA) 的变化规律, 结合PLFA生物标记反映微生物的适冷性及磁场对活性污泥菌群抗冷冲击性能的强化效果。结果表明, 快速降温导致COD去除率下降40%, 磁场强化可提高COD去除率5%10%, 且有利于低温下革兰氏阴性菌的富集, 同时提高了微生物细胞膜内PLFA的多样性及微生物适冷性, 进而提高了污水处理效率。

温度对微生物的新陈代谢起着决定作用, 温度降低会导致微生物最大比生长速率和基质利用率下降, 同时导致废水的物理和化学性质发生变化, 影响生物反应器的性能。在研究中发现, 过快的冷却速率会导致细胞内形成胞内冰, 造成细胞的损伤。低温 (0~10℃) 已成为目前生物水处理领域面临的一大难题。
低温生化法处理污水工艺中通常通过考察磷脂脂肪酸 (PLFA) 的特性来反应微生物的适冷性。PLFA为甲基化活性污泥中提取的磷脂后得到的脂肪酸产物, 总在专属的一类微生物中出现, 且一般只存在于活体细胞中。
根据以上特性, PLFA鉴定技术被广泛应用于环境微生物研究领域的微生物群落结构表征。在细胞膜中, 脂类组成是保持膜流动以及相结构的前提, 确保膜中的蛋白质发挥正常的生理功能, 如电子转移、营养吸收等。当温度降低时, 膜流动性会随之减弱, 从而影响膜的相结构和正常功能。因此, 微生物必须通过调节细胞膜内脂类的组成, 改变膜的流动性和相结构, 以适应环境温度的下降, 膜脂质的改变主要是改变脂肪酸的组成。生物膜由磷脂双分子层构成, 双分子层结构具有不对称性, 存在磁各向异性, 磁场导致其发生取向重排作用, 增加膜的通透性, 提高微生物的活性, 从而大大提高了低温废水的生物降解效率。污水处理工艺中针对不同类别的工业及生活污水加入磁场辅助降解有机物, 已经成为一项新兴的水处理技术。
本研究通过磁场强化弥补生物反应器低温运行的不足, 主要考察磁场作用下活性污泥微生物在快速降温、复温冲击条件下的磷脂脂肪酸 (PLFA) 变化规律及污染物去除效率, 结合PLFA生物标记反映微生物的适冷性及磁场对活性污泥菌群抗冷冲击能力的强化效果, 为改善低温污水生物处理效果提供依据。
1.研究方法
1.1 实验设计
本实验设计活性污泥反应器在快速降温及复温条件下运行, 研究低温下活性污泥微生物抗冷冲击 (Cold-shock) 性能及污水处理效果。实验设计如下: (1) 将反应器置于生化培养箱内, 通过温度控制器调节培养温度。25℃下培养2个模拟序批式活性污泥反应器 (SBR) A1、A2, 反应器为3L的有机玻璃柱, 高度和半径分别为30cm、5cm;A2在中心场强为30m T的磁场下运行 (磁场以平行放置的2块异极磁铁产生, 通过调节磁铁间距控制中心场强) , A1为A2的对照组, 无磁场设置。
(2) 反应器在经过常温培养后, A1、A2经历快速降温及复温过程 (瞬时转移至0℃及瞬时转移至25℃) 。
(3) 反应历经S1~S7 7个阶段, S1为反应器常温下驯化稳定后25℃运行, S2-S4为快速降温后低温下运行, S5~S7为快速复温后25℃运行, 每个阶段运行5d。
(4) 模拟废水组成:C6H12O6、NH4Cl、KH2PO4, 以自来水配水浓度为400mg/L, 其中C:N:P为100:5:1 (质量比) 。
(5) 设置反应器循环周期为12h, 每个反应器内放置1 L模拟废水和1 L活性污泥, 曝气量为4.0L/min, 水力停留时间 (HRT) 为10h, 固体停留时间 (SRT) 为10d。
(6) 反应为序批式运行, 进水时间、反应时间、沉降时间分别为0.2h、10h、1h, 过程中溶氧量为8.20~8.65mg/L。
(7) 污泥取自南京某污水处理厂, 装入反应器前污泥MLSS为4200mg/L。
1.2 实验方法
1.2.1 COD测定
COD测定方法采用快速密闭催化消解法。
1.2.2 PLFA提取与命名
PLFA通过提取与分离、皂化、甲基化、萃取、洗涤等处理, 采用安捷伦7890A气相色谱测定。气相色谱各参数由MIDI Sherlock程序设置调用。PLFA常用的命名格式为X:YωZ (c/t) , 其中, X是总碳数;Y为双键数;ω表示甲基末端;Z是距离甲基端的距离;C表示顺式, t表示反式;a和i分别表示支链的反异构和异构;10Me表示一个甲基团在距分子末端第10个碳原子上;环丙烷脂肪酸用cy表示。
1.2.3 统计分析
磷脂脂肪酸数据通过SPSS18.0软件进行分析。在主成分分析 (PCA) 中, 个别PLFA含量以占PLFA总样本中百分比的形式表示。经过SPSS软件降维得到2个主成分, 它们包含超过80%的差异度。
Shannon-Wiener多样性指数通常被定义为:
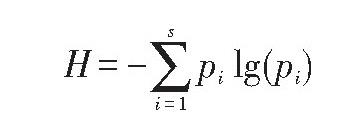
式中, H为Shannon-Wiener指数, s是每个样品中磷脂脂肪酸的总数, pi为各磷脂脂肪酸占总峰面积的百分比。气相色谱分析的峰面积用来计算每个磷脂脂肪酸的pi值。
2.结果与分析
2.1 COD降解率
图1描述了反应器整个运行过程中的COD去除率变化情况。A1和A2在S1常温运行阶段保持76.8%~77.2%的平均COD去除率, 在S2阶段2个反应器瞬时转移至0℃, COD去除率受到大幅度影响, 在S2~S4阶段A1和A2的平均去除率分别为32.7%和37.6%;在S5阶段2个反应器瞬时转移至室温, 反应器COD处理效率有一定的提高, 在S5~S7阶段A1和A2的平均去除率分别为70.2%和73.7%。快速降温对2个反应器微生物有较大的冲击, 导致COD去除率大幅下降;S2~S4阶段A2的去除率高于A1可以发现, 磁场对反应器低温下COD去除率有正向的强化作用, 对低温下微生物适冷性有一定的促进作用。同理在复温后, A2反应器的去除率说明磁场强化更有利于活性污泥微生物低温损伤的恢复及提高微生物降解有机物的效能。
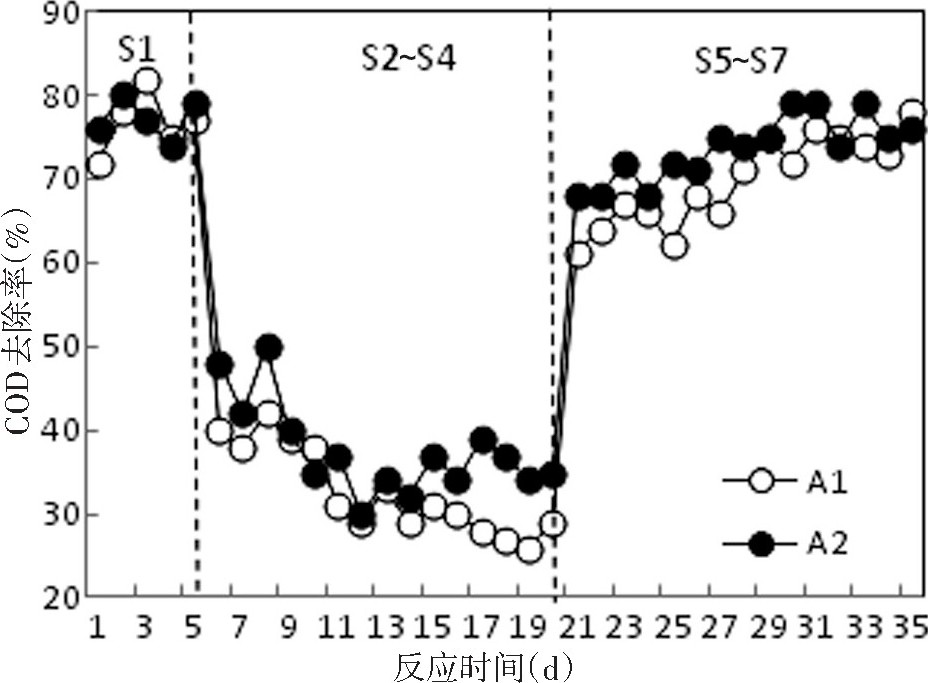
图1 反应器不同阶段COD去除率
2.2 PLFA生物标记及脂肪酸分类分析
反应器各阶段运行末期整个PLFA的碳链长度主要分布在C10~C20。微生物种群结构即不同类群微生物的相对丰度, 可以通过微生物各种群的特征脂肪酸的相对含量表征。PLFA生物标记可反映生物量、革兰氏阳性菌、革兰氏阴性菌和真菌的相对含量。生物量与十六烷脂肪酸 (16:0) 有着正相关关系, 可用该脂肪酸含量来表征总生物量相对大小, 多种支链脂肪酸可表征革兰氏阳性菌, 单不饱和脂肪酸和环丙烷脂肪酸则可指示革兰氏阴性菌, 特定的磷脂脂肪酸 (如18:1ω9、18:2ω6、18:3ω6、18:3ω3) 可用于表征真菌。
图2表示温度变化的不同阶段2个反应器活性污泥菌群的种群结构PLFA生物标记。通过对常温下、降温末期及复温末期各反应器PLFA的测定, 常温下A1的革兰氏阳性菌、革兰氏阴性菌和真菌所占比例与A2对应微生物比例都比较接近。降温后历经S2~S4阶段, 2个反应器的革兰氏阳性菌及真菌含量均有所降低, A2的革兰氏阴性菌比例明显高于A1。复温后, 两个反应器生物量均有所下降, A1、A2的真菌含量恢复至降温前的水平。
冷激实验主要考察在短时间内微生物受冷冲击所发生的相应生理功能的变化。在降温S4阶段, 2个反应器革兰氏阳性菌出现下降趋势, 与其短时间内受低温抑制有关;有研究表明低温下革兰氏阴性菌有更好的适冷性, A2的革兰氏阴性菌含量高于A1说明低温下磁场强化有利于革兰氏阴性菌的富集;复温后2个反应器较低的生物量说明快速降温及复温的扰动导致反应器微生物受到一定程度损伤;真菌受温度变化扰动相对较小, 但降温及复温冲击下A2真菌量高于A1, 说明磁场强化有利于真菌富集, 提高了反应器内的生物多样性。
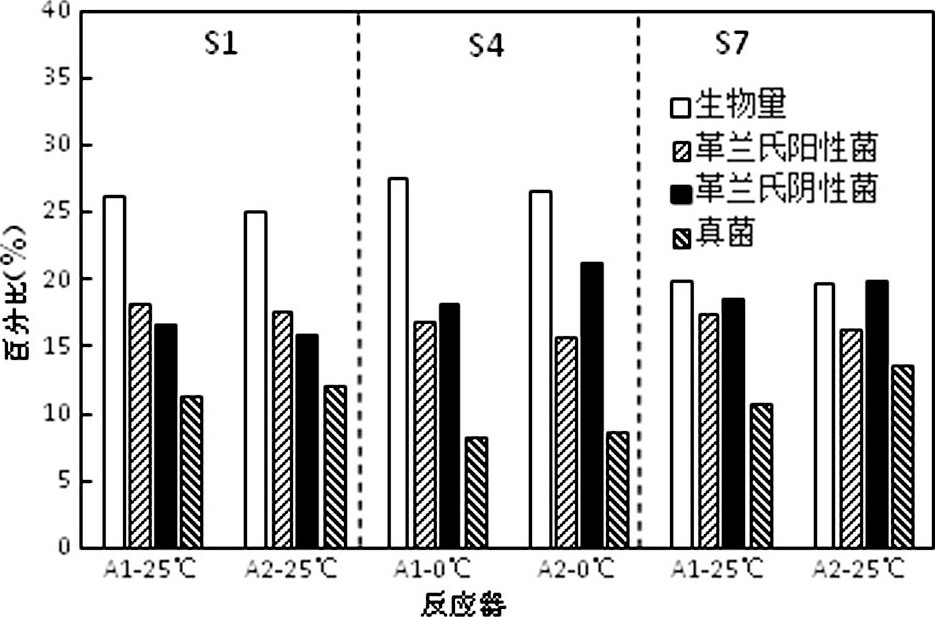
图2 温度变化过程中PLFA生物标记及活性污泥菌群变化
2.3 不饱和脂肪酸含量分析
图3描述了2个反应器中的不饱和脂肪酸含量的变化, 从图3可以看出, C16:1ω7c、C18:1ω7c、C18:1ω9c 3种不饱和脂肪酸在每个反应器微生物细胞膜中占主要成分 (平均含量>5%) 。在降温末期A1和A2的不饱和脂肪酸含量明显低于常温运行阶段, 同时A2的不饱和脂肪酸含量略高于A1;在复温阶段2个反应器的不饱和脂肪酸含量有所回升, 但仍低于降温前的水平。
微生物细胞膜中不饱和脂肪酸含量反映了微生物的适冷能力, 研究表明Bacillus subtilis中的脂肪酸去饱和酶对微生物抗冷冲击具有积极的作用, 同时有研究表明不饱和脂肪酸对微生物适应低温环境具有促进作用。快速降温导致2个反应器微生物活性受到抑制, 且微生物难以在短时间内调整膜内不饱和脂肪酸含量以适应环境;A2反应器含量在降温和复温阶段均接近A1说明磁场对快速降温下微生物不饱和脂肪酸的强化作用较弱, 同时体现快速降温对微生物通过不饱和脂肪调节机体适冷性的机能冲击较大。
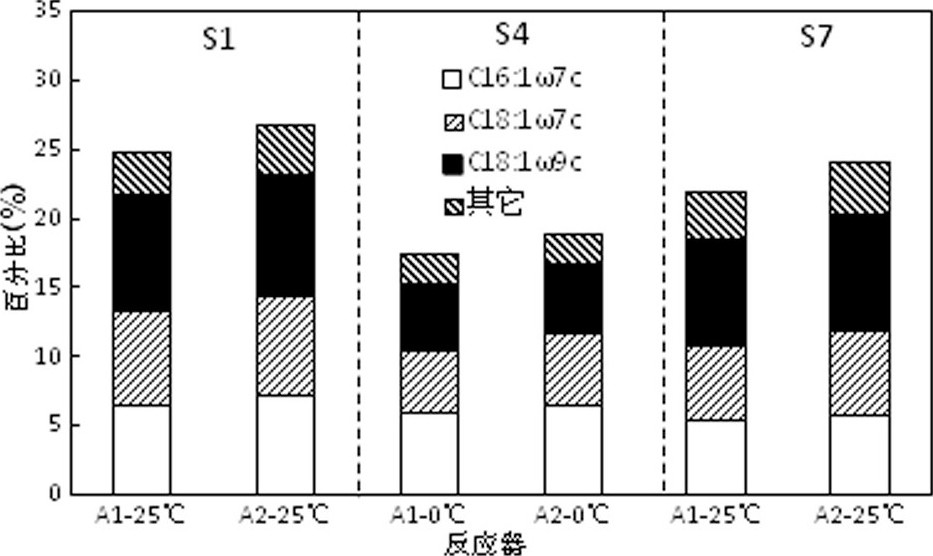
图3 反应器不同阶段微生物细胞膜不饱和脂肪酸情况
2.4 主成分分析
主成分分析 (PCA) 可以通过2个反应器PLFA的状况反映微生物种群的变化。主成分1 (PC1) 和主成分2 (PC2) 分别含有52%和35%的差异度。从图4可以看出, 因子C14:0 iso、C15:0 anteiso、C16:0 iso和C17:0 cyclo在PC1上有较高的负荷, 因子C16:1ω7c、C18:1ω7c、C18:1ω9c在主成分2上有较高的负荷。在快速降温末期与常温阶段相比, A1在PC1上有较大差异度, A2在PC2上有较大差异度;在S4阶段, A1和A2在PC1和PC2上均有差异度。
温度是影响微生物生长导致磷脂脂肪酸组成差异的主要因素之一, 同时A1和A2之间的差异反映在PC1和PC2。PC1上高负荷的因子多为支链脂肪酸, 此为革兰氏阳性菌的生物标记因子;单烯不饱和脂肪酸在PC2上有较高负荷, 此为革兰氏阴性菌的生物标记。温度作为主要环境因子直接导致革兰氏阳性菌和革兰氏阴性菌在微生物群落上的多样性差异, 同时在受到快速降温冷冲击后, A1与A2的差异度表明磁场强化同样导致2个反应器微生物菌群的多样性差异。
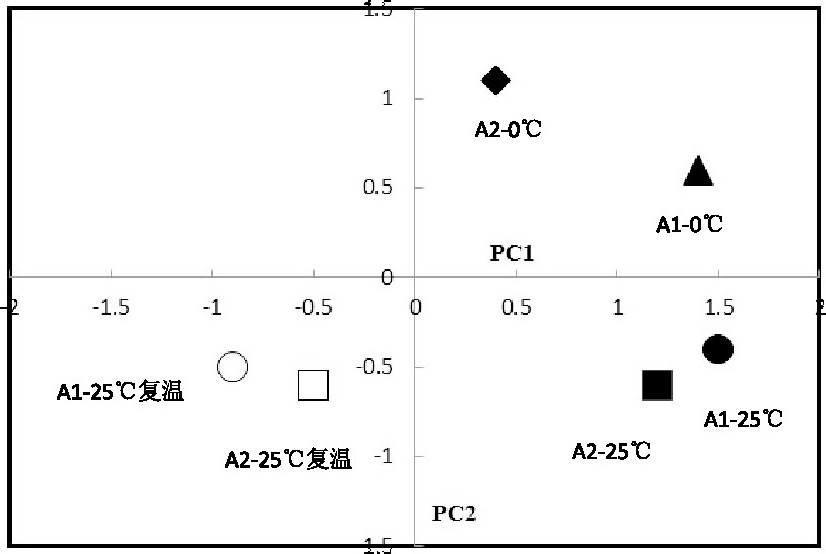
图4 反应器不同阶段磷脂脂肪酸主成分分析
2.5 Shannon-Wiener生物多样性分析
微生物种群的多样性体现种群结构的稳定程度, 相对稳定的种群结构对于生物反应器内微生物降解有机物具有积极的促进作用。为了考察PLFA的丰富度和均匀度, 运用ShannonWiener多样性指数反映微生物种群多样性。温度变化的不同阶段2个反应器活性污泥PLFA的Shannon-Wiener多样性指数如图5所示。从图5可以看出, 在降温末期A1、A22个反应器PLFA多样性相比于常温阶段均有降低, A1降幅最大 (5.74%) , A2的PLFA多样性在低温运行末期下降相对较小 (3.25%) 。在复温后A1、A2的PLFA多样性恢复甚至超过降温前的水平, 且A1的多样性指数相对更高。
降温会抑制中温微生物生长活性, 使之休眠甚至死亡, 低温微生物逐渐成为优势菌群, 但是由于低温微生物生长速率相对较慢, 世代时间较长, 在数量上很难达到中温微生物的水平, 造成低温污水中微生物总量减少, 总体活性降低, 同时低温下物种数量会随之减少, 导致PLFA多样性相应减小。快速降温冲击下A2更高的多样性指数表明磁场强化有利于提高微生物细胞膜内PLFA的多样性。复温后中温微生物开始大量繁殖, 活性污泥微生物总量和种群数量逐渐恢复, 含有特定PLFA的物种数量也随之增加, 使2个反应器PLFA多样性提高, 进而提高低温下污水处理效率。
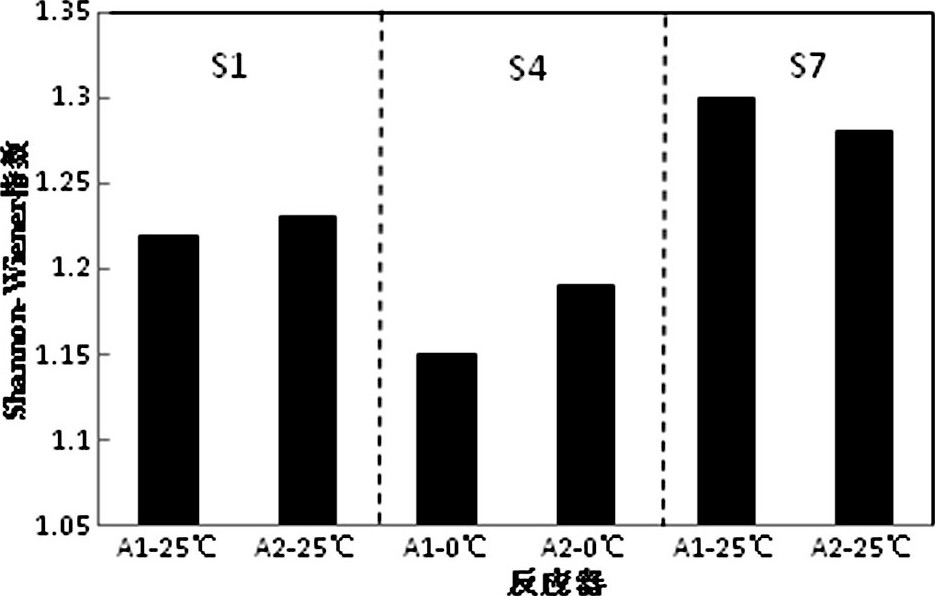
图5 不同阶段磷脂脂肪酸Shannon-Wiener多样性指数
3.结论
(1) 快速降温导致反应器COD去除率大幅下降, 低温运行阶段A1和A2的平均去除率分别为32.7%和37.6%, 磁场强化提高了A2的COD去除率。
(2) 快速降温下磁场强化有利于革兰氏阴性菌的富集, 同时提高了微生物细胞膜内PLFA的多样性, 但对微生物通过调节不饱和脂肪酸含量增强适冷性的强化作用较弱;主成分分析表明温度和磁场导致快速降温冷冲击下2个反应器革兰氏阳性菌和革兰氏阴性菌在微生物群落上的多样性差异。
(3) 通过磁场强化, 可以弥补快速降温对活性污泥微生物的冲击影响, 同时调节微生物活性及多样性以提高污水处理效率。
.
- 联系我们
-
- 全国统一服务热线
400-086-0510- 企业邮箱
251677379@qq.com - 全国统一服务热线



 全国销售热线:400-086-0510
全国销售热线:400-086-0510




